Osmosis yaitu perpindahan molekul air melalui selaput semipermiabel selektif dari belahan yang lebih encer(zat) ke belahan yang lebih pekat(zat) atau dari belahan yang konsentrasi air tinggi ke konsentrasi air rendah.
Ini juga sanggup dipakai untuk menggambarkan proses fisik di mana pelarut bergerak melintasi membran semipermeabel (permeabel terhadap pelarut, tapi bukan zat terlarut) yang memisahkan dua larutan dengan konsentrasi yang berbeda.
Tekanan osmosis didefinisikan sebagai tekanan eksternal yang dibutuhkan untuk diterapkan sehingga tidak ada pergerakan higienis pelarut di membran.
Tekanan osmotik yaitu sifat koligatif , yang berarti bahwa tekanan osmotik bergantung pada konsentrasi molar zat terlarut namun tidak pada identitasnya.
Osmosis yaitu proses vital dalam sistem biologis, alasannya yaitu membran biologis semipermeabel. Secara umum, membran ini tidak sanggup terbentuk pada molekul besar dan polar , ibarat ion , protein , dan polisakarida , sementara sanggup dimasuki molekul non-polar atau hidrofobik ibarat lipida dan juga molekul kecil ibarat oksigen, karbon dioksida, nitrogen, dan nitrik.
Permeabilitas tergantung pada kelarutan, muatan, atau kimia, serta ukuran zat terlarut. Molekul air berjalan melalui membran plasma, membran tonoplast (vakuola) atau protoplas dengan membuatkan seluruh lapisan ganda fosfolipid melalui aquaporin (protein transmembran kecil yang serupa dengan yang bertanggung jawab untuk kanal difusi dan ion difasilitasi).
Osmosis menyediakan sarana utama dimana air diangkut masuk dan keluar dari sel. Tekanan turgor dari sel sebagian besar dipertahankan oleh osmosis melintasi membran sel antara interior sel dan lingkungannya yang relatif hipotonik.
Ketika sel terendam air , molekul air melewati membran sel dari tempat konsentrasi zat terlarut rendah hingga konsentrasi zat terlarut tinggi. Misalnya, kalau sel terendam air asin, molekul air keluar dari sel. Jika sel terendam air tawar, molekul air bergerak ke sel.
Bila membran mempunyai volume air murni di kedua sisi, molekul air masuk dan keluar di setiap arah pada tingkat yang sama persis. Tidak ada anutan air higienis melalui membran.
Mekanisme yang bertanggung jawab untuk mengemudikan osmosis umumnya telah diwakili dalam teks biologi dan kimia baik sebagai pengenceran air dengan zat terlarut (menghasilkan konsentrasi air yang lebih rendah pada sisi konsentrasi zat terlarut yang lebih tinggi dari membran dan oleh alasannya yaitu itu difusi air sepanjang gradien konsentrasi) atau oleh daya tarik zat terlarut terhadap air (menghasilkan air yang kurang bebas pada konsentrasi yang lebih tinggi dari sisi konsentrasi zat terlarut dan oleh alasannya yaitu itu pergerakan higienis air ke zat terlarut). Kedua gagasan ini telah disangkal secara meyakinkan.
Model difusi osmosis tidak sanggup dipertahankan oleh fakta bahwa osmosis sanggup mengarahkan air melintasi membran menuju konsentrasi air yang lebih tinggi.
Model "air terikat" disangkal oleh fakta bahwa osmosis terlepas dari ukuran molekul zat terlarut - sifat koligatif - atau bagaimana hidrofiliknya.
Sulit untuk menggambarkan osmosis tanpa klarifikasi mekanis atau termodinamika, namun pada dasarnya, ada interaksi antara zat terlarut dan air yang menetralkan tekanan yang bisa dilakukan molekul bebas zat terlarut bebas.
Satu fakta yang perlu diperhatikan yaitu bahwa panas dari sekitarnya bisa diubah menjadi energi mekanik (air naik).
Banyak klarifikasi termodinamika masuk ke konsep potensi kimia dan bagaimana fungsi air pada sisi larutan berbeda dari air murni alasannya yaitu tekanan yang lebih tinggi dan adanya zat terlarut yang bereaksi sehingga potensi kimiawi tetap tidak berubah.
Teorema virial mengatakan bahwa daya tarik antara molekul (air dan zat terlarut) mengurangi tekanan, dan dengan demikian tekanan yang diberikan oleh molekul air satu sama lain dalam larutan kurang dari pada air murni, yang memungkinkan air murni untuk "memaksa" larutan hingga tekanan mencapai ekuilibrium.
Ketika sel tumbuhan ditempatkan dalam larutan yang bersifat hipertonik relatif terhadap sitoplasma, air bergerak keluar dari sel dan sel menyusut.
Dengan melakukannya, sel menjadi lembek. Dalam kasus yang ekstrim, sel menjadi plasmolyzed - membran sel terlepas dengan dinding sel alasannya yaitu kurangnya tekanan air di atasnya.
Ketika sel tumbuhan ditempatkan dalam larutan yang bersifat hipotonik terhadap sitoplasma, air bergerak ke sel dan sel membengkak menjadi letupan.
Osmosis bertanggung jawab atas kemampuan akar tumbuhan untuk menarik air dari tanah. Tanaman mengkonsentrasikan zat terlarut ke dalam sel akar mereka melalui transport aktif, dan air memasuki akar oleh osmosis. Osmosis juga bertanggung jawab mengendalikan gerakan sel penjaga.
Osmosis sanggup ditunjukkan ketika irisan kentang ditambahkan ke larutan garam tinggi. Air dari dalam kentang bergerak ke solusi, mengakibatkan kentang mengecil dan kehilangan 'tekanan turgor'. Semakin terkonsentrasi larutan garamnya, semakin besar perbedaan ukuran dan berat potongan kentang.
Dalam lingkungan yang tidak biasa, osmosis bisa sangat berbahaya bagi organisme. Sebagai contoh, ikan akuarium air tawar dan air asin ditempatkan di air dengan kadar garam yang berbeda dari pada tempat biasanya, mereka akan segera mati, dan dalam kasus ikan air asin, hal ini terjadi secara dramatis.
Contoh lain dari imbas osmotik yang berbahaya yaitu penggunaan garam meja untuk membunuh lintah dan siput.
Misalkan seekor binatang atau sel tumbuhan ditempatkan dalam larutan gula atau garam dalam air.
Jika medium hipotonik relatif terhadap sitoplasma sel - sel akan mendapat air melalui osmosis.
Jika mediumnya isotonik - tidak akan ada pergerakan higienis air melintasi membran sel.
Jika medium hipertonik relatif terhadap sitoplasma sel - sel akan kehilangan air dengan osmosis.
Intinya, ini berarti bahwa kalau sel dimasukkan ke dalam larutan yang mempunyai konsentrasi zat terlarut lebih tinggi dari pada yang dimilikinya, ia akan mengerut, dan kalau dimasukkan ke dalam larutan dengan konsentrasi zat terlarut lebih rendah daripada pada dirinya sendiri, sel akan membengkak dan mungkin bahkan meledak.
Kebun kimia mengatakan imbas osmosis dalam kimia anorganik.
Seperti disebutkan sebelumnya, osmosis sanggup ditentang dengan meningkatkan tekanan di tempat konsentrasi zat terlarut tinggi berkenaan dengan konsentrasi rendah pada konsentrasi zat terlarut.
Gaya per satuan luas, atau tekanan, yang dibutuhkan untuk mencegah anutan air melalui membran permeabel selektif dan ke dalam larutan dengan konsentrasi lebih besar sama dengan tekanan larutan osmotik, atau turgor. Tekanan osmotik yaitu sifat koligatif , artinya properti bergantung pada konsentrasi zat terlarut, namun tidak pada identitasnya. Ini juga terlibat dalam difusi difasilitasi.
Gradien osmotik
Gradien osmotik yaitu perbedaan konsentrasi antara dua larutan di kedua sisi membran semipermeabel , dan dipakai untuk membedakan perbedaan konsentrasi partikel spesifik yang dilarutkan dalam larutan.
Biasanya gradien osmotik dipakai ketika membandingkan solusi yang mempunyai membran semipermeabel di antara keduanya sehingga memungkinkan air berdifusi di antara dua larutan, menuju larutan hipertonik (larutan dengan konsentrasi lebih tinggi).
Akhirnya, kekuatan kolom air di sisi hipertonik membran semipermeabel akan menyamai gaya difusi pada sisi hipotonik (sisi dengan konsentrasi lebih rendah), membuat keseimbangan. Ketika ekuilibrium tercapai, air terus mengalir, namun mengalir baik dalam jumlah yang sama maupun gaya, oleh alasannya yaitu itu menstabilkan solusinya.
Artikel utama: Reverse osmosis
Reverse osmosis yaitu proses pemisahan yang memakai tekanan untuk memaksa pelarut melalui membran semi permeabel yang mempertahankan zat terlarut di satu sisi dan memungkinkan pelarut murni lolos ke sisi lain, memaksanya dari tempat konsentrasi zat terlarut tinggi melalui membran ke tempat konsentrasi zat terlarut rendah dengan menerapkan tekanan melebihi tekanan osmotik.
Teruskan osmosis
Artikel utama: Teruskan osmosis
Osmosis sanggup dipakai secara eksklusif untuk mencapai pemisahan air dari larutan yang mengandung zat terlarut yang tidak diinginkan.
Larutan "menarik" dari tekanan osmotik yang lebih tinggi daripada larutan umpan dipakai untuk menginduksi anutan air higienis melalui membran semi permeabel, sehingga larutan umpan menjadi terkonsentrasi ketika larutan penarik menjadi encer.
Larutan imbas yang diencerkan kemudian sanggup dipakai secara eksklusif (seperti zat terlarut ibarat glukosa), atau dikirim ke proses pemisahan sekunder untuk menghilangkan zat terlarut.
Pemisahan sekunder ini bisa lebih efisien daripada proses reverse osmosis saja, tergantung pada zat terlarut yang dipakai dan air umpan yang diobati. Teruskan osmosis yaitu bidang penelitian yang sedang berlangsung, dengan fokus pada aplikasi desalinasi , pemurnian air , pengolahan air , pengolahan masakan , dll.
Tag: #osmosis #kimia #biokimia #zat
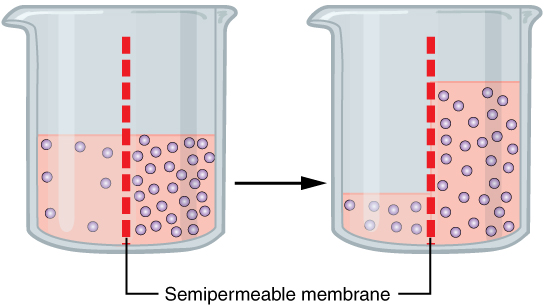 |
| Proses osmosis |
Tekanan osmosis didefinisikan sebagai tekanan eksternal yang dibutuhkan untuk diterapkan sehingga tidak ada pergerakan higienis pelarut di membran.
Tekanan osmotik yaitu sifat koligatif , yang berarti bahwa tekanan osmotik bergantung pada konsentrasi molar zat terlarut namun tidak pada identitasnya.
Osmosis yaitu proses vital dalam sistem biologis, alasannya yaitu membran biologis semipermeabel. Secara umum, membran ini tidak sanggup terbentuk pada molekul besar dan polar , ibarat ion , protein , dan polisakarida , sementara sanggup dimasuki molekul non-polar atau hidrofobik ibarat lipida dan juga molekul kecil ibarat oksigen, karbon dioksida, nitrogen, dan nitrik.
Permeabilitas tergantung pada kelarutan, muatan, atau kimia, serta ukuran zat terlarut. Molekul air berjalan melalui membran plasma, membran tonoplast (vakuola) atau protoplas dengan membuatkan seluruh lapisan ganda fosfolipid melalui aquaporin (protein transmembran kecil yang serupa dengan yang bertanggung jawab untuk kanal difusi dan ion difasilitasi).
Osmosis menyediakan sarana utama dimana air diangkut masuk dan keluar dari sel. Tekanan turgor dari sel sebagian besar dipertahankan oleh osmosis melintasi membran sel antara interior sel dan lingkungannya yang relatif hipotonik.
Sejarah Osmosis
Jean-Antoine Nollet pertama kali mendokumentasikan pengamatan osmosis pada tahun 1748. Kata "osmosis" turun dari kata-kata "endosmosis" dan "eksosmosis", yang diciptakan oleh dokter Prancis René Joachim Henri Dutrochet (1776-1847) dari bahasa Yunani kata ἔνδον ( éndon "within"), ἔξω ( éxō "outer, external"), dan ὠσμός ( ōsmós "push, impulsion").Proses Osmosis
Osmosis yaitu gerakan pelarut melintasi membran semipermeabel menuju konsentrasi zat terlarut yang lebih tinggi. Dalam sistem biologi, pelarutnya biasanya air, tapi osmosis sanggup terjadi pada cairan lain, cairan superkritis, dan bahkan gas.Ketika sel terendam air , molekul air melewati membran sel dari tempat konsentrasi zat terlarut rendah hingga konsentrasi zat terlarut tinggi. Misalnya, kalau sel terendam air asin, molekul air keluar dari sel. Jika sel terendam air tawar, molekul air bergerak ke sel.
Bila membran mempunyai volume air murni di kedua sisi, molekul air masuk dan keluar di setiap arah pada tingkat yang sama persis. Tidak ada anutan air higienis melalui membran.
Mekanisme yang bertanggung jawab untuk mengemudikan osmosis umumnya telah diwakili dalam teks biologi dan kimia baik sebagai pengenceran air dengan zat terlarut (menghasilkan konsentrasi air yang lebih rendah pada sisi konsentrasi zat terlarut yang lebih tinggi dari membran dan oleh alasannya yaitu itu difusi air sepanjang gradien konsentrasi) atau oleh daya tarik zat terlarut terhadap air (menghasilkan air yang kurang bebas pada konsentrasi yang lebih tinggi dari sisi konsentrasi zat terlarut dan oleh alasannya yaitu itu pergerakan higienis air ke zat terlarut). Kedua gagasan ini telah disangkal secara meyakinkan.
Model difusi osmosis tidak sanggup dipertahankan oleh fakta bahwa osmosis sanggup mengarahkan air melintasi membran menuju konsentrasi air yang lebih tinggi.
Model "air terikat" disangkal oleh fakta bahwa osmosis terlepas dari ukuran molekul zat terlarut - sifat koligatif - atau bagaimana hidrofiliknya.
Sulit untuk menggambarkan osmosis tanpa klarifikasi mekanis atau termodinamika, namun pada dasarnya, ada interaksi antara zat terlarut dan air yang menetralkan tekanan yang bisa dilakukan molekul bebas zat terlarut bebas.
Satu fakta yang perlu diperhatikan yaitu bahwa panas dari sekitarnya bisa diubah menjadi energi mekanik (air naik).
Banyak klarifikasi termodinamika masuk ke konsep potensi kimia dan bagaimana fungsi air pada sisi larutan berbeda dari air murni alasannya yaitu tekanan yang lebih tinggi dan adanya zat terlarut yang bereaksi sehingga potensi kimiawi tetap tidak berubah.
Teorema virial mengatakan bahwa daya tarik antara molekul (air dan zat terlarut) mengurangi tekanan, dan dengan demikian tekanan yang diberikan oleh molekul air satu sama lain dalam larutan kurang dari pada air murni, yang memungkinkan air murni untuk "memaksa" larutan hingga tekanan mencapai ekuilibrium.
Contoh Osmosis
Tekanan osmotik merupakan penyebab utama pertolongan pada banyak tanaman. Masuknya osmotik air menjadikan tekanan turgor yang melekat pada dinding sel , hingga sama dengan tekanan osmotik, membuat keadaan mapan.Ketika sel tumbuhan ditempatkan dalam larutan yang bersifat hipertonik relatif terhadap sitoplasma, air bergerak keluar dari sel dan sel menyusut.
Dengan melakukannya, sel menjadi lembek. Dalam kasus yang ekstrim, sel menjadi plasmolyzed - membran sel terlepas dengan dinding sel alasannya yaitu kurangnya tekanan air di atasnya.
Ketika sel tumbuhan ditempatkan dalam larutan yang bersifat hipotonik terhadap sitoplasma, air bergerak ke sel dan sel membengkak menjadi letupan.
Osmosis bertanggung jawab atas kemampuan akar tumbuhan untuk menarik air dari tanah. Tanaman mengkonsentrasikan zat terlarut ke dalam sel akar mereka melalui transport aktif, dan air memasuki akar oleh osmosis. Osmosis juga bertanggung jawab mengendalikan gerakan sel penjaga.
Osmosis sanggup ditunjukkan ketika irisan kentang ditambahkan ke larutan garam tinggi. Air dari dalam kentang bergerak ke solusi, mengakibatkan kentang mengecil dan kehilangan 'tekanan turgor'. Semakin terkonsentrasi larutan garamnya, semakin besar perbedaan ukuran dan berat potongan kentang.
Dalam lingkungan yang tidak biasa, osmosis bisa sangat berbahaya bagi organisme. Sebagai contoh, ikan akuarium air tawar dan air asin ditempatkan di air dengan kadar garam yang berbeda dari pada tempat biasanya, mereka akan segera mati, dan dalam kasus ikan air asin, hal ini terjadi secara dramatis.
Contoh lain dari imbas osmotik yang berbahaya yaitu penggunaan garam meja untuk membunuh lintah dan siput.
Misalkan seekor binatang atau sel tumbuhan ditempatkan dalam larutan gula atau garam dalam air.
Jika medium hipotonik relatif terhadap sitoplasma sel - sel akan mendapat air melalui osmosis.
Jika mediumnya isotonik - tidak akan ada pergerakan higienis air melintasi membran sel.
Jika medium hipertonik relatif terhadap sitoplasma sel - sel akan kehilangan air dengan osmosis.
Intinya, ini berarti bahwa kalau sel dimasukkan ke dalam larutan yang mempunyai konsentrasi zat terlarut lebih tinggi dari pada yang dimilikinya, ia akan mengerut, dan kalau dimasukkan ke dalam larutan dengan konsentrasi zat terlarut lebih rendah daripada pada dirinya sendiri, sel akan membengkak dan mungkin bahkan meledak.
Kebun kimia mengatakan imbas osmosis dalam kimia anorganik.
Faktor Yang Menyebabkan Osmosis
Tekanan osmotikSeperti disebutkan sebelumnya, osmosis sanggup ditentang dengan meningkatkan tekanan di tempat konsentrasi zat terlarut tinggi berkenaan dengan konsentrasi rendah pada konsentrasi zat terlarut.
Gaya per satuan luas, atau tekanan, yang dibutuhkan untuk mencegah anutan air melalui membran permeabel selektif dan ke dalam larutan dengan konsentrasi lebih besar sama dengan tekanan larutan osmotik, atau turgor. Tekanan osmotik yaitu sifat koligatif , artinya properti bergantung pada konsentrasi zat terlarut, namun tidak pada identitasnya. Ini juga terlibat dalam difusi difasilitasi.
Gradien osmotik
Gradien osmotik yaitu perbedaan konsentrasi antara dua larutan di kedua sisi membran semipermeabel , dan dipakai untuk membedakan perbedaan konsentrasi partikel spesifik yang dilarutkan dalam larutan.
Biasanya gradien osmotik dipakai ketika membandingkan solusi yang mempunyai membran semipermeabel di antara keduanya sehingga memungkinkan air berdifusi di antara dua larutan, menuju larutan hipertonik (larutan dengan konsentrasi lebih tinggi).
Akhirnya, kekuatan kolom air di sisi hipertonik membran semipermeabel akan menyamai gaya difusi pada sisi hipotonik (sisi dengan konsentrasi lebih rendah), membuat keseimbangan. Ketika ekuilibrium tercapai, air terus mengalir, namun mengalir baik dalam jumlah yang sama maupun gaya, oleh alasannya yaitu itu menstabilkan solusinya.
Variasi Jenis Osmosis
Reverse osmosis (RO)Artikel utama: Reverse osmosis
Reverse osmosis yaitu proses pemisahan yang memakai tekanan untuk memaksa pelarut melalui membran semi permeabel yang mempertahankan zat terlarut di satu sisi dan memungkinkan pelarut murni lolos ke sisi lain, memaksanya dari tempat konsentrasi zat terlarut tinggi melalui membran ke tempat konsentrasi zat terlarut rendah dengan menerapkan tekanan melebihi tekanan osmotik.
Teruskan osmosis
Artikel utama: Teruskan osmosis
Osmosis sanggup dipakai secara eksklusif untuk mencapai pemisahan air dari larutan yang mengandung zat terlarut yang tidak diinginkan.
Larutan "menarik" dari tekanan osmotik yang lebih tinggi daripada larutan umpan dipakai untuk menginduksi anutan air higienis melalui membran semi permeabel, sehingga larutan umpan menjadi terkonsentrasi ketika larutan penarik menjadi encer.
Larutan imbas yang diencerkan kemudian sanggup dipakai secara eksklusif (seperti zat terlarut ibarat glukosa), atau dikirim ke proses pemisahan sekunder untuk menghilangkan zat terlarut.
Pemisahan sekunder ini bisa lebih efisien daripada proses reverse osmosis saja, tergantung pada zat terlarut yang dipakai dan air umpan yang diobati. Teruskan osmosis yaitu bidang penelitian yang sedang berlangsung, dengan fokus pada aplikasi desalinasi , pemurnian air , pengolahan air , pengolahan masakan , dll.
Tag: #osmosis #kimia #biokimia #zat
Share This :


comment 0 comments
more_vert